Wąglik jest zakaźną chorobą zwierzęcą utrzymującą się przez wiele lat na określonym obszarze. Występuje endemicznie w kilku regionach świata, między innymi w południowej i wschodniej Europie. Czynnikiem etiologicznym choroby jest gram-dodatnia, przetrwalnikująca bakteria Bacillus anthracis, która atakuje przede wszystkim zwierzęta roślinożerne, takie jak kozy, owce i bydło. Znajdujące się w powietrzu i w produktach odzwierzęcych spory stanowią zagrożenie również dla człowieka. Najwięcej uwagi poświęca się płucnej postaci wąglika, która może wskazywać na użycie przetrwalników bakterii jako broni biologicznej.
Historia
Nazwa wąglik pochodzi od greckiego słowa anthrakis, to znaczy węgiel i nawiązuje do objawów choroby, czyli czarnych zmian skórnych występujących na ciele zarażonych osób.
Obecnie chorobę tą kojarzymy przede wszystkim z „pocztowymi atakami”, które miały miejsce w USA w 2001 roku. Była ona jednak znana ludziom już od wieków i stanowiła przekleństwo hodowców zwierząt roślinożernych. Poczatkowo jej przyczyny pozostawały niejasne. Zaobserwowano jedynie, że zapada na nią głównie bydło przetrzymywane na konkretnych pastwiskach, nazywanych z tego powodu przeklętymi polami.
Sprawcę epidemii poznano dopiero w 1876 roku. Dokonał tego Robert Koch, który z zakażonych zwierząt wyizolował czystą kulturę bakterii Bacillus anthracis, za pomocą której zdołał wywołać chorobę u zdrowych osobników. Na podstawie tych obserwacji, niemiecki uczony sprecyzował cztery uniwersalne postulaty diagnostyczne, pozwalające wykazać relację między obecnością badanego mikroorganizmu, a występującym schorzeniem.
Nie wyjaśniało to jednak, dlaczego choroba występuje wciąż na tych samych polach. Rozwiązanie zagadki przedstawił w 1881 roku Francuz Ludwik Pasteur. Według jego teorii chore, pozostawione na pastwisku zwierzęta stanowią źródło przetrwalników bakteryjnych, połykanych przez dżdżownice i roznoszonych wraz z odchodami po całym, pokrytym trawą obszarze. Rozsiane w ten sposób spory powodują nowe zakażenia. Uczony przeprowadził również pierwsze szczepienia ochronne, które położyły kres wybuchającym epidemiom. Podawane zwierzętom bakterie odzjadliwiano za pomocą wysokiej temperatury.
Wiele lat później współpracownik Pasteura – Ilja Miecznikow odkrył, że szczepy atentowane pozbawione są tzw. otoczki utrudniającej układowi odpornościowemu przeprowadzenie fagocytozy. Drugi czynnik wirulencji B. anthracis, czyli silną toksynę zwaną antraks, odkryto dopiero w 1954 roku.
Bacillus anthracis
Bacillus anthracis jest tlenową, gram-dodatnią, nieurzęsioną i nieruchomą bakterią tworzącą przetrwalniki.
Jej komórki wegetatywne mają kształt laseczek o kwadratowych końcach i wymiarach 1-8 μm długości i 1-1,5 μm szerokości. Hodowane na stałym podłożu, tworzą kolonie o białym zabarwieniu. Na morfologię tych kolonii wpływa obecność otoczki – pozbawione jej szczepy są szorstkie i nierówne, natomiast te posiadające otoczkę są gładkie i mają śluzowatą konsystencję.
Kolonie mocno przylegają do powierzchni pożywki agarowej i ich przenoszenie za pomocą ezy lub wykałaczki może prowadzić do utworzenia się łańcuszków złożonych z komórek i ułożonych prostopadle do powierzchni agaru. W zakażonych tkankach obserwuje się jednak najczęściej jedynie pojedyncze komórki lub krótkie łańcuszki.
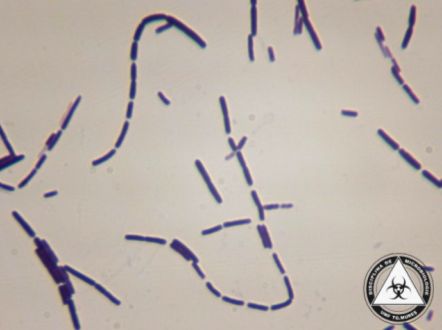
Rys. 1. Bacillus anthracis po wybarwieniu metodą grama; obraz widziany pod mikroskopem, powiększenie x100 (źródło: atlas mikrobiologiczny http://atlas.microumftgm.ro/)
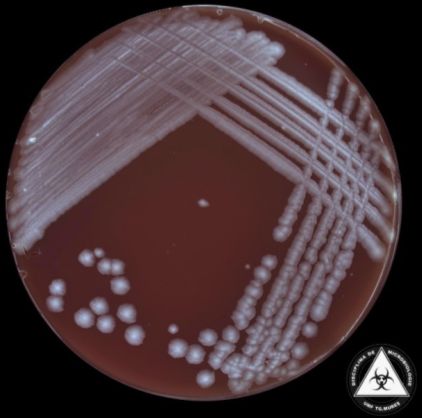
Rys. 2. Kolonie Bacillus anthracis na stałej pożywce (źródło: atlas mikrobiologiczny http://atlas.microumftgm.ro/)
Przetrwalniki
Komórka wegetatywna B. anthracis nie jest w stanie przeżyć poza organizmem zwierzęcia lub człowieka dłużej niż kilka dni. W niekorzystnych warunkach bakterie te tworzą zatem przetrwalniki, czyli twory niezwykle odporne na wszelkie zmiany zachodzące w środowisku zewnętrznym. Spory mogą przetrwać w glebie nawet dziesiątki lat. Sporulacja nigdy nie odbywa się w żywym organizmie. Zachodzi jednak w martwych tkankach i w krwi wystawionej na działanie powietrza oraz jako efekt prowadzenia długotrwałej hodowli na różnych pożywkach.
Przetrwalniki wąglika kiełkują dopiero w korzystnych warunkach środowiskowych, takich jak krew i tkanki zwierząt lub człowieka, stanowiące doskonałe źródło substancji odżywczych, to znaczy aminokwasów, nukleozydów i glukozy, która razem z dwuwęglanem stanowi czynnik pobudzający produkcję otoczki. Również panująca wewnątrz ciała temperatura (37°C) jest optymalna dla prowadzenia hodowli. W takich warunkach ilość bakterii ulega podwojeniu już po 30 – 60 minutach.
Przedmiotem ostatnich badań jest zapotrzebowanie B. anthracis na żelazo. Jak większość ssaczych patogenów bakteria ta wykształciła różne sposoby pozyskiwania owego składnika mineralnego, silnie związanego z białkami transportowymi i zapasowymi gospodarza. Między innymi wydziela ona dwa rodzaje siderophorów: bacillobaktynę (ang. bacillibactin) i petrobaktynę (ang. petrobactin), które z dużym powinowactwem chelatują jony żelaza. Związane jony są transportowane do wnętrza bakterii na zasadzie transportu aktywnego (transportery ABC). B. anthracis może również pozyskiwać żelazo z hemu i białek wiążących hem, w tym z hemoglobiny. Wykorzystuje przy tym specjalne białka (ang. iron-regulated surface determinant (Isd) proteins): IsdX1 (znany również jako IsdJ), IsdX2 (inaczej IsdK) i IsdC zawierające domeny NEAT (ang. near iron transporter), które umożliwiają tworzenie połączeń z ligandami zawierającymi żelazo.
Wirulencja
B. anthracis różni się od pokrewnych sobie gatunków tym, że podczas zakażenia ssaczego gospodarza wytwarza dwa czynniki wirulencji: toksynę zwaną antraks oraz otoczkę zbudowanej z poli-D-glutaminianu. Ich synteza odbywa się również podczas prowadzenia kultury w warunkach przypominających środowisko panujące wewnątrz organizmów żywych.
Geny warunkujące wirulencję są zlokalizowane na plazmidach pXO1 i pXO2. Ważną rolę odgrywają również chromosomalne geny sap i eag kodujące białka Sap i EA1, czyli składniki tzw. powierzchniowej warstwy S (ang. S-layer). Struktura ta pokrywa ścianę komórki bakteryjnej i wraz z otoczką chroni laseczkę wąglika przed działaniem układu immunologicznego gospodarza.
Plazmidy
Plazmidy B. anthracis pXO1 i pXO2 odkryto w latach 80-tych. Oprócz innych genów zawierają one również informację niezbędną do produkcji otoczki i toksyny. Obecnie, ze względów bezpieczeństwa, w laboratoriach stosuje się szczepy atentowane, to znaczy zawierające jedynie jeden z dwóch rodzajów plazmidów.
Szczepy typu „Sterne” (nazwane tak ponieważ po raz pierwszy zostały odkryte przez M. Sterne w 1939 roku), np. szczep Sterne, 34F2, STI, Weybridge, zawierają pXO1, natomiast nie posiadają pXO2. Szczepy typu „Pasteur”, takie jak 6602, 4229, zawierają pXO2, natomiast są pXO1-negatywne.
Zarówno pXO1, jak i pXO2 są stabilnie utrzymywane przez B. anthracis rosnący w warunkach in vivo podczas infekcji. W warunkach widocznego braku jakiejkolwiek presji selekcyjnej, częściej zachodzi spontaniczna utrata pXO2. Stabilność pXO1 jest prawdopodobnie związana z zakodowaną na tym plazmidzie topoizomerazą typu 1. B. anthracis może zostać pozbawiony obu typów plazmidów podczas hodowli 43°C lub też w obecności subletalnych stężeń novobiocyny.
Sekwencja DNA pXO1 jest w większości przypadków stała. Plazmid ten ma dwie wyspy patogeniczności. Pierwsza zawiera geny kodujące białka strukturalne toksyny: pagA związany z wytwarzaniem antygenu ochronnego (ang. protective antygene, PA), lef produkujący czynnik letalny (ang. lethal factor, LF) i cya związane z produkcją czynnika obrzęku (ang. edema factor, EF). Drugą wyspę patogeniczności stanowi operon gerX obejmujący geny odpowiedzialne za kiełkowanie przetrwalników B. anthracis w makrofagach: gerXA, ger XB, gerXC.
Plazmid pXO2 zawiera operon <em.capBCADE obejmujący geny odpowiedzialne za wytwarzanie i degradację otoczki, tzn. capA, capB, capC kodujące enzymy związane z błoną komórkową bakterii.
Zarówno pXO1, jak i pXO2 zdają się replikować jednokierunkowo według modelu theta, czyli według schematu replikacji chromosomu bakteryjnego.
Otoczka
Większość bakterii posiada otoczki zbudowane z polisacharydów. Otoczka B. anthracis składa się natomiast z heptanu – poli-D-glutaminianu i uniemożliwia fagocytozę bakterii przez układ odpornościowy gospodarza. Jej obecność pełni zatem istotną rolę w pierwszym etapie patogenezy, czyli tzw. inwazji.
Wytwarzanie otoczki poprzedza kiełkowanie spor i następuje dopiero w organizmie żywiciela lub na pożywce zawierającej dwuwęglany, czyli główne formy CO2 w organizmie. Stężenie dwuwęglanów reguluje na poziomie transkrypcji ekspresję genu acpA, obecnego na plazmidzie pXO2. Transkrypcję genu capB warunkuje natomiast obecność białek regulatorowych AcpA i AtxA. Są one również aktywatorami transkrypcji genów odpowiedzialnych za syntezę antraksu.
Egzotoksyna antraks
Przez wiele lat naukowcy byli przekonani, że B. anthracis wytwarza tylko jeden czynnik wirulencji. Produkcja śmiercionośnej toksyny odbywa się jedynie przez bardzo krótki okres czasu, co znacznie utrudniało jej odkrycie.
Antraks zbudowany jest z trzech białkowych komponentów, które dopiero po połączeniu warunkują zjadliwość bakterii. Wyróżnia się wśród nich:
• dwie alternatywne podjednostki A:
EF (ang. edema factor), czyli kodowana przez gen cya, zależna od wapnia i kalmoduliny cyklaza adenylanowa. W połączeniu z białkiem PA tworzy toksynę warunkującą występowanie opuchlizny (ang. edema toxin, EdTx);
LF (lethal factor), kodowana przez lef, zależna od cynku metaloproteinazą, która poprzez proteolizę białek kinazy MAP inaktywuje szlaki sygnałów komórkowych. W połączeniu z białkiem PA tworzy letalną toksynę (ang. lethal toxin, LeTx ) prowadzącą do śmierci organizmu gospodarza;
• podjednostka B
PA (ang. protective antigen) kodowana przez gen pagA.
W pierwszym etapie PA łączy się z receptorami ATR (ang. anthrax toxin receptor) zlokalizowanymi na powierzchni atakowanych komórek. Prowadzi to do aktywującego rozszczepienia PA i utworzenia tzw. PA63 stanowiących podjednostki heptametrycznego poru (PA63)7 wiążącego EF i / lub LF. Powstały w ten sposób kompleks ulega internalizacji na drodze endocytozy.
Pochłonięte cząsteczki powinny zostać stopniowo zdegradowane przez komórkowe proteazy. Niskie pH panujące wewnątrz endosomu pobudza jednak wbudowanie się porów PA w błonę, co umożliwia translokację podjednostek EF i LF poprzez membranę endosomu do cytozolu.
Białko EF wiąże się następnie z obecną w komórce kalmoduliną i nabywa dzięki temu właściwości cyklazy adenylanowej, katalizującej przejście ATP w cykliczny AMP (cAMP), czyli przekaźnik II typu. Zwiększenie poziomu cAMP w komórce jest przyczyną zaburzeń szeregu procesów komórkowych takich jak np. transport jonów.
Białko LF blokuje natomiast transdukcję szklaków sygnałowych warunkujących prawidłową odpowiedź immunologiczną organizmu. Odbywa się to poprzez inaktywację wewnątrzkomórkowych kinaz serynowo-treoninowych MEK (MEK1, MEK2, MEK3). W ten sposób nie dochodzi o aktywacji kinazy MAPK (ang. mitogen-activated protein kinase) stanowiącej ważne ogniwo w procesach regulacyjnych cyklu komórkowego i aktywacji takich komórek odpornościowych jak limfocyty i makrofagi. Sprzyja to rozprzestrzenianiu się bakterii i rozwojowi infekcji.
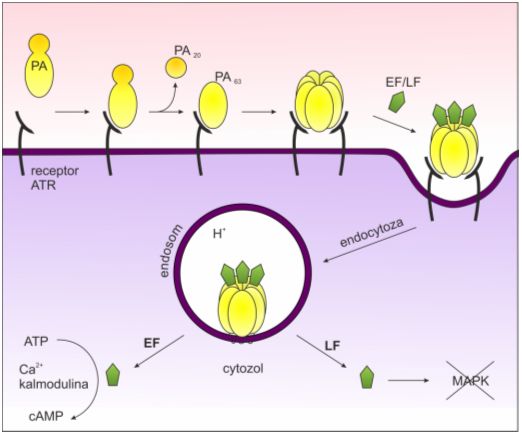
Rys. 3. Toksyna antraks wnika do komórki na drodze endocytozy, a jej obecność powoduje zaburzenia istotnych procesów komórkowych
Toksyna antraks znalazła zastosowanie m.in. w badaniach naukowych. Za pomocą czynnika PA wprowadza się do wnętrza komórki antygeny wirusowe prezentowane następnie przez cząsteczki głównego kompleksu zgodności tkankowej MHC I. Dzięki temu można opracowywać nowe szczepionki np. przeciw HIV i WZW C (wirusowe zapalenie wątroby typu C, ang. hepatitis C virus, HCV)) oraz studiować w warunkach in vitro funkcje limfocytów Tc.
Regulacja genów kodujących toksynę i otoczkę
Ekspresja genów warunkujących wytwarzanie otoczki i toksyny może być regulowana na wiele sposobów.
Ważna rolę odgrywa tutaj białko AtxA (ang. anthrax toxin activator). Jest ono zakodowane w plazmidzie pXO1 i pełni rolę ogólnego regulatora transkrypcji genów B. anthracis (zawartych na plazmidach i na chromosomie). Molekularny mechanizm działania tego białka nie został jeszcze poznany. Wiadomo jednak, że wywiera ono bardzo silny, pozytywny efekt na geny kodujące toksynę, takie jak pagA, cya, lef, a pozbawione go mutanty nie wykazują cech zjadliwości. AtxA kontroluje również wytwarzanie innego białka regulatorowego AcpA (ang. anthrax capsule activator), czyli zakodowanego na plazmidzie pXO2 aktywatora genu capB.
Na ekspresję czynników wirulencji mają również wpływ faza hodowli (największą produkcję obserwuje się przy przejściu z fazy wykładniczej do fazy stacjonarnej) oraz warunki panujące w środowisku zewnętrznym. Należy jednak zaznaczyć, że temperatura odgrywa ważną rolę jedynie przy produkcji toksyny i nie wykazano jej wpływu na wytwarzanie otoczki. Obecność dwuwęglanów stymuluje natomiast syntezę obu czynników wirulencji. Organizmy pozbawione genów odpowiedzialnych za transport dwuwęglanów nie posiadały cech zjadliwości.
Identyfikacja
Identyfikacja bakterii B. anthracis jest stosunkowo łatwa i polega na przeprowadzeniu testów na właściwości biochemiczne kolonii hodowanych na sztucznych podłożach. Obecnie w tym celu stosuje się również techniki oparte na reakcji PCR. Poszczególne szczepy bakterii różnią się między sobą liczbą i lokalizacją tandemowych powtórzeń, które można analizować za pomocą metody MVLA (ang. multi-locus variable-number tandem repeat analysis). Cechę tę wykorzystano m.in. przy identyfikacji wąglika użytego w atakach bioterrorystycznych w USA.
Patogeneza oraz objawy kliniczne
Objawy choroby związane są z drogą wnikania B. anthracis do organizmu gospodarza. Na tej podstawie można wyróżnić trzy postacie wąglika:
• wziewną, inhalacyjną lub inaczej płucną
Postać wziewna występuje stosunkowo rzadko w warunkach naturalnych. Charakteryzuje się jednak najwyższą śmiertelnością sięgającą nawet 95%.
Ten rodzaj zakażenia stanowi główną przyczyną zgonów następujących w wyniku rozpylenia przetrwalników B. anthracis jako broni biologicznej. W związku z tym stwierdzenie nawet jednego przypadku choroby wymaga zaalarmowania odpowiednich służb.
Warunkiem rozwoju bakterii jest dotarcie spor do pęcherzyków płucnych. Tam, są one fagocytowane przez makrofagi. Część przetrwalników nie zostaje jednak zniszczona i naczyniami limfatycznymi wędruje do węzłów chłonnych zlokalizowanych w śródpiersiu. Ich kiełkowanie może nastąpić nawet po 60 dniach od zakażenia. Od tego momentu choroba postępuje bardzo szybko. Mnożące się bakterie wydzielają toksynę powodującą obrzęk, krwotok i martwicę. Zgon następuje po osiągnięciu pewnego krytycznego stężenia toksyny we krwi, nawet w przypadku, gdy w organizmie nie ma już bakterii.
Chorego można uratować dzięki szybkiej interwencji polegającej na natychmiastowym podaniu antybiotyków. Typowe symptomy pierwszej fazy są jednak zbliżone do objawów grypy (gorączka, bóle mięśni, bóle głowy, wymioty, dreszcze, osłabienie i suchy kaszel) i w związku z tym wczesne rozpoznanie wziewnej postaci wąglika jest zatem bardzo trudne. Dodatkowo chorobie może towarzyszyć przejściowa poprawa stanu zdrowia. Faza druga charakteryzuje się gwałtownym wzrostem gorączki, dusznościami, potami oraz wstrząsem. Objawom tym może towarzyszyć powiększenie węzłów chłonnych śródpiersia oraz krwotoczne zapalenie opon mózgowo-rdzeniowych. Szybko rozwijająca się sinica oraz obniżenie ciśnienia tętniczego mogą doprowadzić do nagłego zgonu.
Przeprowadzone na zwierzętach badania wykazały, że pomocne w walce z choroba może się okazać wyrównanie gospodarki kwasowo-zasadowej i równowagi elektrolitowej, podanie choremu glukozy we wlewie dożylnym, stosowanie leków wazopresynowych oraz wczesne rozpoczęcie wentylacji wspomaganej.
• skórna
Postać skórna stanowi najczęstszą naturalną postać wąglika. Charakteryzuje się stosunkowo niską śmiertelnością sięgającą około 20%. Również okres utajenia tego typu wąglika jest stosunkowo krótki.
Zagrożone są głównie osoby mające kontakt z zakażonymi zwierzętami, a zmiany chorobowe rozwijają się najczęściej na odsłoniętych okolicach ciała, takich jak ramiona, ręce, twarz i szyja.
Znajdujące się na skórze przetrwalniki kiełkują i wydzielają toksynę wywołującą miejscowy obrzęk. Swędzące plamki przekształcają się szybko w okrągłe owrzodzenie, z którego wycieka przejrzysty lub surowiczo-krwisty płyn. Z czasem obrzęk powiększa się i tworzą się wrzosy martwicze, czyli wysychające i odpadające od ciała czarne strupy. Zakażenie może rozprzestrzeniać się na cały organizm powodując posocznicę. Dzięki szybkiemu podaniu antybiotyków można zmniejszyć ryzyko wystąpienia objawów ogólnych.
• żołądkowo-jelitowa
Ta postać wąglika jest rzadko spotykana, a jej śmiertelność szacuje się na 50%. Do zakażenia dochodzi w wyniku spożyciu niedogotowanego i skażonego mięsa. W ten sposób przetrwalniki przedostają się do górnego lub dolnego odcinak przewodu pokarmowego. Postać ustno-gardłowa obejmuje owrzodzenie jamy ustnej i przełyku, któremu towarzyszy powiększenie okolicznych węzłów chłonnych i obrzęk. Zmiany jelitowe obejmują najczęściej końcowy odcinek jelita cienkiego lub kątnicy. Typowe objawy to nudności, wymioty i krwista biegunka. W obu przypadkach może również dochodzić do rozwinięcia się posocznicy.
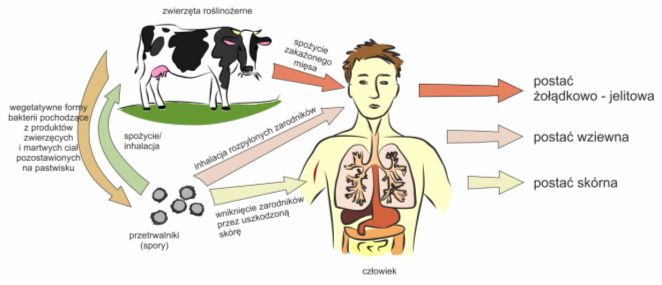
Rys. 4. Postać wąglika zależy od dróg wnikania B. anthracis do organizmu człowieka
Kontrola zakażeń
Do zakażenia człowieka wąglikiem może poprzez bezpośredni kontakt z chorymi zwierzętami, produktami pochodzenia zwierzęcego oraz skażoną wodę. Do grupy największego ryzyka należą m.in. pracownicy sortujący i obrabiający wełnę w zakładach przemysłowych, garbarze oraz osoby zatrudnione w zakładach przetwarzających kozią sierść lub skóry.
Osoby, które raz zetkną się z bakteriami Bacillus anthracis w większości przypadków pozostają odporne na ponowne zakażenie wąglikiem.
Zwalczanie choroby polega głównie na właściwym usuwaniu zwłok zwierzęcych i zakażonych materiałów, które mogą powodować wystąpienie choroby u innych zwierząt. Należy unikać balsamowania ciał, a po przeprowadzeniu autopsji wszystkie, użyte do tego celu, narzędzia i materiały powinno się poddać sterylizacji w autoklawie lub spalić. Przedmioty można również skutecznie oczyścić za pomocą takich środków dezynfekcyjnych jak podchloryn, stosowany powszechnie w szpitalach.
Podczas postępowania z chorymi osobami zaleca się zachowanie standardowych środków ostrożności. Nie jest konieczne stosowanie masek ochronnych o filtrach dużej wydajności. W przypadku osób kontaktujących się z chorymi nie zaleca się również przeprowadzania profilaktycznych szczepień ochronnych, ani terapii antybiotykowych. Nie powinno się zwłaszcza zażywać antybiotyków bez uprzedniej konsultacji z lekarzem, gdyż skutki takiego postępowania mogą się okazać bardzo niebezpieczne.
Szczepienie
Obecnie zarejestrowane są dwie szczepionki przeciwko wąglikowi: stosowana w USA AVA (ang. adsorber vaccine) oraz brytyjska AVP (ang. precipitated vaccine). Obie są zaprojektowane w taki sposób, aby indukować odpowiedź organizmu na PA, jednak AVP w porównaniu a AVA posiada niższe koncentracje PA i większą zawartość pozostałych antygenów B. anthracis, takich jak LF, czy EF oraz niektóre białka powierzchniowe bakterii. Wpływa to nieznacznie na większą skuteczność szczepionki AVP.
Alternatywne podejście do szczepionek opartych na PA obejmuje m.in. modyfikację rekombinowanego PA oraz wzmocnienie odpowiedzi gospodarza poprzez zastosowanie odpowiednich adjuwantów immunologicznych, tzn. substancji wzmagających reakcję immunologiczną w stosunku do różnych antygenów.
Prowadzone są także badania nad innymi sposobami dostarczania szczepionki do organizmu, tzn. bez użycia igieł. Najbardziej prawdopodobna wydaje się perspektywa aplikacji poprzez błony śluzowe nosa, czyli tą samą drogą, jaką dostają się do organizmu zarodniki zawarte w aerozolach.
Opracowywane są również tzw. szczepionki DNA oraz szczepionki atentowane zawierające odzjadliwione szczepy B. anthracis. W planach jest wykorzystanie antygenów otoczki oraz atentowanych, całych przetrwalników lub ich antygenów (BclA, BxpB i inne).
Inną możliwością jest profilaktyka bierna polegająca na podawaniu gotowych przeciwciał, Anti-PA, Anti-LF, Anti-capsule i innych.
Autor: Anna Kurcek
Literatura:
1. Cybulski R. J.,Sanz P., O’Brien A. D., 2009. Anthrax vaccination strategies. Molecular Aspects of Medicine 30(6): 490–502.
2. Gel F., 1986. Pogromca niewidzialnych drapieżników. Wydawnictwo „Śląsk”, Katowice.
3. Inglesby T.V., Henderson D.A., Bartlett J.G., Ascher M.S., Eitzen E., Friedlander A.M., Hauer J., McDade J., Osterholm M.T., O’Toole T., Parker G., Perl T.M., Russell P.K., Tonat K.,1999. Wąglik jako broń biologiczna – rozpoznawanie, leczenie i aspekty zdrowia publicznego. JAMA, 18: 1735-1745.
4. Koehler T. M., 2009. Bacillus anthracis Physiology and Genetics. Molecular Aspects of Medicine, 30(6): 386–396.
5. Państwowa Inspekcja Sanitarna http://www.gis.gov.pl/?dep=313
6. Van Der Goot G., Young J. A.T., 2009. Receptors of anthrax toxin and cell entry. Molecular Aspects of Medicine, 30 (6): 406–412.
7. Zasada A. A., Gierczyński R., Kałużewski S., Jagielski M., 2005. Wirulotypy szczepów Bacillus anthracis izolowanych na terenie Polski. Medycyna Doświadczalna i Mikrobiologia, 57: 269-275.

