Autor: Marcelina Olszak
Uniwersytet Przyrodniczy w Lublinie
Aminy biogenne to aktywne biologicznie zasady organiczne o małych masach cząsteczkowych. Występują powszechnie w organizmach zwierzęcych, roślinach oraz w mikroorganizmach. Z jednej strony są to związki niezbędne do utrzymania żywotności komórek oraz prawidłowego przebiegu wielu procesów metabolicznych. Są naturalnymi składnikami surowców roślinnych i zwierzęcych. Niskie stężenia amin biogennych nie stanowią zagrożenia dla człowieka. Naturalnie uczestniczą one w syntezie hormonów, alkaloidów, białek i kwasów nukleinowych. Ponadto wpływają na przepuszczalność błon komórkowych oraz na replikację DNA. Odgrywają istotną rolę w regulacji temperatury ciała, aktywności mózgu i ciśnienia tętniczego [4].
Poziom wiedzy społeczeństwa na temat występowania amin biogennych w żywności jest niski. Istnieje przekonanie, że to drobnoustroje obecne w żywności są przyczyną zatruć pokarmowych. Tymczasem mikroorganizmy wpływają na organizm pośrednio. Natomiast bezpośrednimi czynnikami wywołującymi zatrucie są ich metabolity m.in. aminy biogenne [1].
Podział amin biogennych
Aminy biogenne ze względu na strukturę chemiczną dzielone są na trzy grupy:
1. alifatyczne – monoaminy (metyloamina, dimetyloamina), poliamidy (agmatyna, kadaweryna, spermidyna, putrescyna);
2. aromatyczne (dopamina, noradrenalina, tyramina, adrenalina);
3. heterocykliczne – indolowe (serotonina, tryptamina), imidazolowe (histamina).
Tab. 1 Charakterystyka amin biogennych
| Grupa amin | Charakterystyka |
| Aminy alifatyczne | Składniki wszystkich żywych komórek. Pełnią szereg funkcji fizjologicznych i biologicznych. Ich źródłem może być dieta, endogenna biosynteza oraz mikroorganizmy jelitowe. |
| Aminy aromatyczne | Klasyfikowane są do neurotransmiterów zwanych katecholamin, ze względu na obecność pierścienia katecholowego i aminowego łańcucha bocznego. |
| Aminy heterocykliczne | W dużych ilościach występują z błonie śluzowej żołądka, jelit, w wątrobie, mięśniach, płucach, skórze oraz w leukocytach. |
Opracowanie własne na podstawie [1].
Powstawanie amin biogennych
Aminy powstają na skutek dekarboksylacji aminokwasów obojętnych oraz zasadowych. Aminy lotne powstają również w wyniku redukcyjnego aminowania lub transaminacji aldehydów i ketonów. Czynnikami, które warunkują powstawanie amin biogennych w żywności jest dostępność wolnych aminokwasów i mikroorganizmów zdolnych do biosyntezy enzymów katalizujących ich dekarboksylację. Na ich powstawanie wpływ mają warunki umożliwiające wzrost drobnoustrojów i biosyntezę dekarboksylaz [4].
Wolne aminokwasy uwalniane są w wyniku proteolizy oraz są naturalnymi składnikami produktów żywnościowych. Zatem ryzyko występowania dużej ilości amin biogennych występuje w produktach o wysokiej zawartości białka oraz zawierających szczepy bakterii charakteryzujących się wysoką aktywnością enzymów proteolitycznych. Do mikroorganizmów sprzyjających powstawaniu tych związków należy wiele gatunków z rodzajów: Clostridium, Bacillus, Citrobacter, Klebsiella, Escherichia, Listeria, Micrococcus, Salmonella, Shigella, Staphylococcus, Photobacterium, Plesiomonas, Proteus, Pseudomonas, Shewanella, Lactobacillus, Lactococcus, Pediococcus, Streptococcus, Carnobacterium, Leuconostoc i Enterococcus [4].
Aminy biogenne w żywności
Aminy biogenne są dostarczane do organizmu człowieka razem z pożywieniem. Niskie stężenia nie stanowią zagrożenia dla zdrowia. Natomiast podwyższona zawartość w produktach spożywczych jest wynikiem mikrobiologicznej dekarboksylacji aminokwasów zachodzącej podczas fermentacji, przetwarzania i przechowywania surowców lub wynikiem aktywności enzymów endogennych zawartych w surowcach [4]. Najwyższą zawartość tych związków stwierdzono w produktach pochodzenia zwierzęcego m.in. z mięsie, rybach oraz serze. Niższą zawartość odnotowano w owocach, warzywach, czekoladzie i napojach alkoholowych [3]. Istnieje wiele czynników, które wpływają na powstawanie amin biogennych. Należą do nich pH, temperatura, zawartość soli i cukru oraz dostępność substratów. Wszystkie te czynniki mają wpływ na akumulowanie się amin biogennych w organizmie człowieka [1].
Aminy biogenne występujące w wysokich stężeniach mogą być przyczyną zatruć pokarmowych i alergii. Ponadto może wystąpić podrażnienie skóry, biegunka, wysypka, ból głowy, zaburzenia oddychania, spadek ciśnienia, a nawet objawy wstrząsu anafilaktycznego. Szkodliwe działanie amin może być nasilone u osób z genetycznym niedoborem dwuaminooksydazy (DAO), u osób przyjmujących leki z grupy inhibitorów monoaminooksydazy (MAO) oraz spożywających alkohol [2,3].
Toksyczność amin biogennych
Za zatrucia pokarmowe najczęściej odpowiedzialne są histamina, putrescyna i tyramina. Trudno jest ustalić jednoznacznie toksyczny poziom amin biogennych, ponieważ jest on indywidualny dla każdego człowieka. Jednakże zaproponowano górne limity tych związków w wielu produktach spożywczych. Przykładowo zawartość histaminy na poziomie 8-40 mg/kg w produktach powoduje jedynie niewielkie zatrucie, przy dawce ponad 40 mg/kg zatrucie jest umiarkowane, natomiast ponad 100 mg/kg ciężkie [2].
Histamina jest najbardziej toksyczną aminą obecną w produktach spożywczych.W żywności wytwarzana jest z wolnej histydyny. Jest trwałym związkiem chemicznym, który nie rozkłada się pod wpływem wysokiej temperatury. Główne efekty, które powoduje to rozszerzenie naczyń krwionośnych, uderzenia gorąca, bóle i zawroty głowy, jak również skurcze mięśni gładkich jelit, skurcze brzuszne i wymioty. Wysoka kumulacja histaminy może prowadzić do niewydolności oddechowej, kołatania serca, pieczenia ust i powstania wysypki. Nietolerancja tego związku przez organizm powoduje również przekrwienie nosa, arytmię, astmatyczny oddech, pokrzywkę, świąd oraz bolesne miesiączkowanie. Poziom histaminy, który wywołuje reakcje alergiczne jest różny i zależny od indywidualnych predyspozycji. Spożycie dawki 5-10 mg histaminy może wywołać reakcję alergiczną u ludzi wrażliwych, pomimo tego że ta dawka jest uważana za dopuszczalny limit. Dawka średnio toksyczna to 100 mg, a bardzo toksyczna 1000 mg. Metabolity histaminy w 68-80% wydalane są wraz z moczem. Histamina najczęściej jest utożsamiana z zatruciami powodowanymi przez ryby makrelowate, ponieważ podczas spożywania makreli, tuńczyka czy sardynek spożywa się duże ilości tego związku. Inne aminy biogenne takie jak kadaweryna i putrescyna nie są bezpośrednio toksyczne jednak poprzez wpływ na histaminę wyraźnie zwiększają jej toksyczny efekt na organizm człowieka. Zgodnie z rozporządzeniem WE 1441/2007 w rybach i produktach rybnych zawartość histaminy jest limitowana do 200 mg/kg [2,5,6].
Putrescyna jest diaminą obecną w wysokich ilościach w produktach roślinnych. Jej prekursorem jest aminokwas niebiałkowy ornityna, który tworzy się w procesie przemian wewnątrzkomórkowych. Gromadzenie putrescyny w roślinie wywoływane jest przez wiele czynników stresowych tj.: niedobór składników mineralnych, intensywne naświetlanie, niedobór wody. Putrescyna spożyta wraz z żywnością łatwo wchłaniana jest z przewodu pokarmowego. W komórkach zwierzęcych putrescyna uczestniczy w procesie kancerogenezy oraz angiogenezy indukowanej przez nowotwory. Badania in vitro potwierdzają wzmożoną syntezę ornityny i putrescyny w procesie proliferacji komórek nowotworowych i wytwarzaniu nowych naczyń krwionośnych guza nowotworowego [2,6].
<strong.Tyramina tworzy się podczas dekarboksylacji aminokwasu L-tyrozyny lub w wyniku hydroksylacji fenyloetyloaminy w wątrobie. Szczególnie wysokie zawartości tej aminy występują w niektórych warzywach i owocach np.: szpinaku, kapuście pomidorach, papryce, awokado i bananach. Ponadto obecna jest w winie, piwie, czekoladzie i serach. U ludzi enzym monoaminooksydaza (MAO) odpowiedzialny jest za katabolizm tyraminy. Istotne jest, że spożycie żywności zawierającej nawet niewielkie ilości tego związku przez osoby przyjmujące leki z grupy inhibitorów enzymu MAO może wywołać wzrost ciśnienia krwi oraz przełom nadciśnieniowy. Badania laboratoryjne na szczurach wykazały, że tyramina w kwaśnym środowisku żołądka w obecności nitrozwiązku, przekształca się w 3-diazotyraminę substancję mutagenną wywołującą nowotwory jamy ustnej [2,5].
Kadaweryna to diamina powstającą w procesie dekarboksylacji aminokwasu L-lizyny. Produkty bogate w prekursor kadaweryny to warzywa strączkowe oraz produkty pochodzenia zwierzęcego[2].
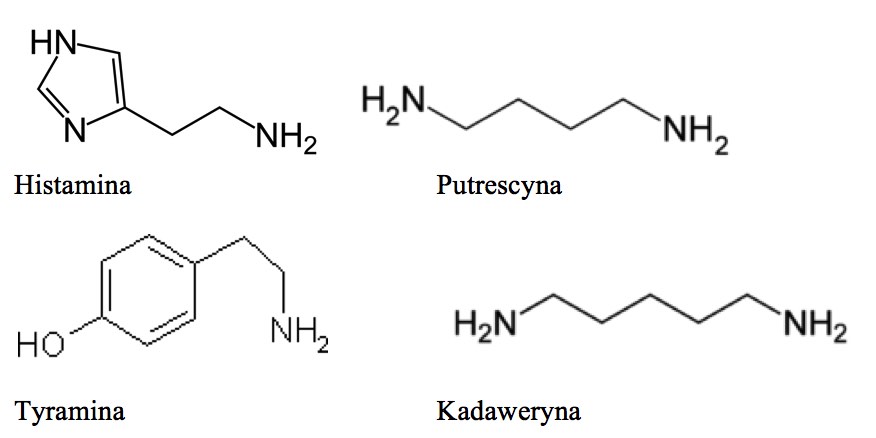
Rys. 1. Wzory strukturalne wybranych amin biogennych.
Aminy biogenne są związkami odpowiedzialnymi za szereg funkcji w organizmie człowieka. Jednak nadmierne ich nagromadzenie w spożywanej żywności może powodować zagrożenie dla organizmu. Z tego powodu wiedza ogólna z zakresu amin biogennych, czynników sprzyjających ich powstawaniu, jak również bezpiecznych limitów w żywności jest przydatna w prewencji negatywnego wpływu na organizm człowieka. Działania profilaktyczne powinny polegać przede wszystkim na przestrzeganiu stanu higienicznego surowców i produktów, właściwych warunków przechowywania żywności oraz odpowiednich procedur technologicznych. Z powodu uzasadnionego negatywnego działania amin biogennych na organizmy żywe, związki te są obecnie przedmiotem badań wielu naukowców [1].
Literatura:
1. Cieślik I., Migdał W. (2011): Aminy biogenne w żywności Bromatologia i Chemia Toksykologiczna. XLIV, 2011, 4, 1087–1096.
2. Gawarska H., Sawilska-Rautenstrauch D., Ścieżyńska H., Minorczyk M., Postupolski J. (2012) Występowanie wolnych amin biogennych: histaminy, tyraminy, putrescyny i kadaweryny w owocach i warzywach oraz ich produktach Bromatologia i Chemia Toksykologiczna. XLV, 2, 105–110.
3. Sawilska-Rautenstrauch D., Fonberg-Broczek M., Gawarska H. Starski A., Jędra M., Karłowski K. (2010): Występowanie amin biogennych w serach dojrzewających pochodzących z rynku warszawskiegoRoczniki Państwowego Zakładu Higieny, 61, Nr 4, 361 – 365.
4. Stadnik J. (2013): Aminy biogenne w wyrobach mięsnych surowo dojrzewających. Żywność. Nauka. Technologia. Jakość, 3 (88), 5 – 15.
5. Szymańska K., Kuśmierska K., Mierzewska H. (2007): Wrodzone zaburzenia metabolizmu amin biogennych i steryn. Neurologia dziecięca 16, 31, 41-50.
6. Woziwodzka A., Piosik J. (2009): Heterocykliczne aminy aromatyczne: charakterystyka i znaczenie w indukcji procesów nowotworowych Biotechnologia 4 (87) 133–151.

